دبي، الإمارات العربية المتحدة (CNN) -- في المرة الأولى التي رأت فيها دوريس تايلور، عالمة الأحياء الجزيئية الخلايا الجذعية للقلب تنبض بانسجام في طبق بتري، أصابها الذهول.
وقالت تايلور، التي أدارت أبحاث الطب التجديدي داخل معهد تكساس للقلب في مدينة هيوستن الأمريكية حتى عام 2020: "لقد غيرت هذه الواقعة حياتي". وتابعت: "لقد قلت لنفسي، يا إلهي، هذه حياة. أردت معرفة كيف ولماذا، وإعادة خلق ذلك لإنقاذ الأرواح".
وأصبح هذا الهدف حقيقة واقعة. وخلال حدث Life Itself للصحة والعافية الذي عُقد الأربعاء، بالشراكة مع CNN، أظهرت تايلور للجمهور سقالات قلب خنزير مضافة إلى خلايا جذعية بشرية، تشكّل قلبًا بشريًا حيويًا ونابضًا لن يرفضه الجسم. لماذا ا؟ لأنه مصنوع من أنسجة ذلك الشخص.
وتابعت تايلور أنه "بات في إمكاننا اليوم تخيّل تشكيل قلب بشري مشخصن، ونقل آلية زرع القلب من إجراء عملية طارئة لأنك مريض جدًا، إلى عملية مخطّط لها".
وأوضحت أنّ "هذا يقلّل من المخاطر التي قد تواجهها لانتفاء الحاجة إلى الأدوية المضادة للحقن في ما بعد، ومن خلال استخدام الخلايا الخاصة بك لتشكيل هذا القلب، تُقلل الكلفة المادية.. فـأنت لن تقصد المستشفى كثيرًا الأمر الذي يحسّن من نوعية حياتك".
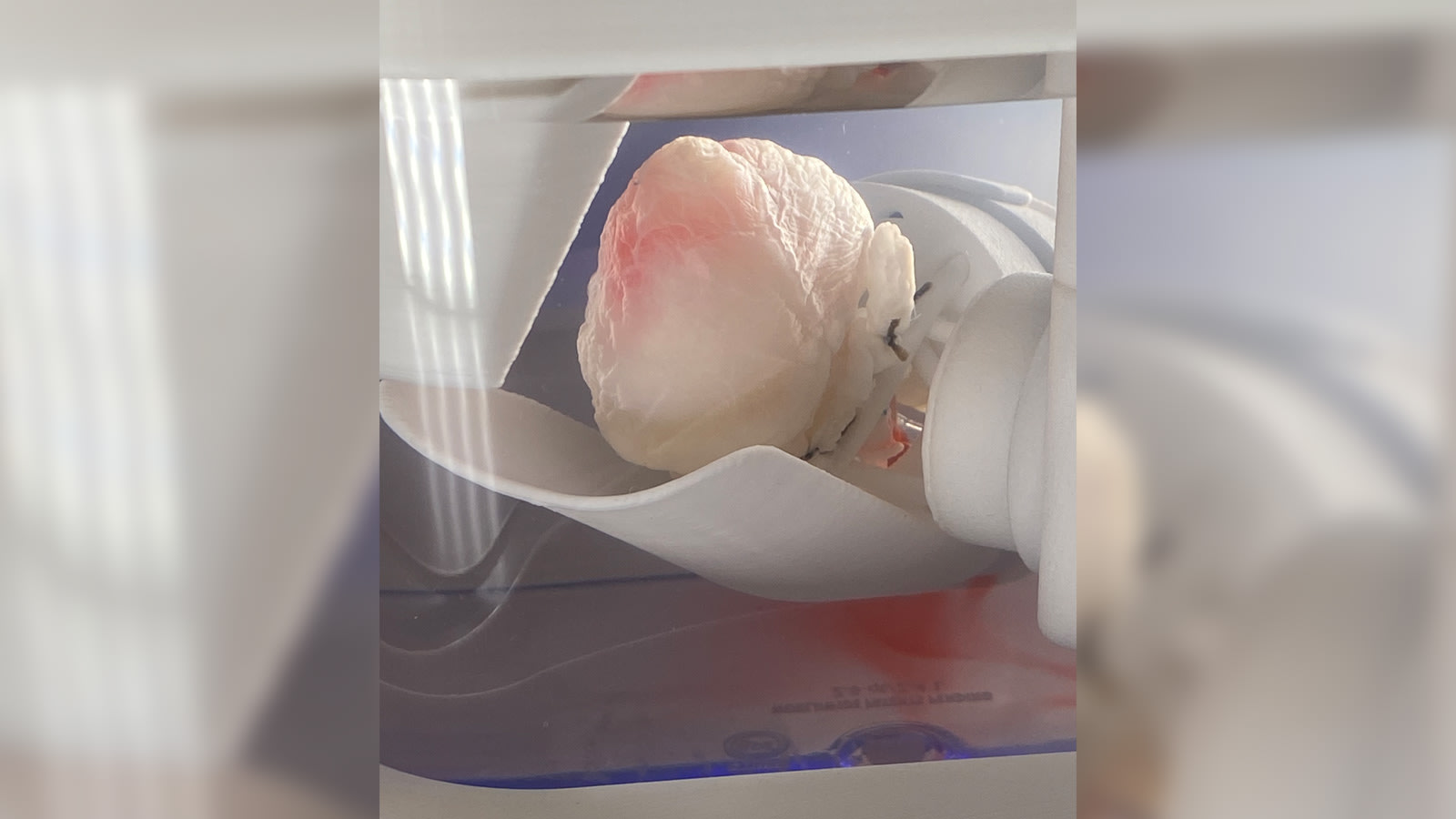
وسجل روبوت تايلور، باب (BAB) ظهوره الأول على المسرح، وتم تعليمه بصعوبة كيفية حقن الخلايا الجذعية في حجرات القلب الشبحية وسط بيئة معقمة. وشاهد جمهور Life Itself "باب" يعمل في بيئة معقمة، كما عرضت تايلور مقاطع فيديو لكتلة بيضاء لؤلؤية تُسمى "قلب الأشباح" وهي تبدأ بالتحوّل إلى اللون الوردي.
وقالت تايلور وسط تصفيق الحضور: "إنها الطلقة العلاجية الأولى الموجهة إلى القاتل الأول للرجال والنساء والأطفال في العالم، مرض القلب. وبعد ذلك، أرغب في أن أتمكن من جعل هذا العلاج متاحًا للجميع".
وقال مايكل غولواي، المخترع الرئيسي لروبوت BAB والرئيس والمدير التنفيذي لشركة "Advanced Solutions"، التي تصمم وتستحدث منصات لبناء الأنسجة البشرية، إن تايلور "لم تستسلم أبدًا".
وفي أي وقت، كان بإمكان الدكتورة تايلور أن تقول بسهولة، إنها عدلت عن الأمر، لأنه لن ينجح. لكنها ثابرت على مدى سنوات، تواجه الإخفاقات بهدف العثور على النوع المناسب من الخلايا بالكميات المناسبة، والظروف المناسبة، لتمكين تلك الخلايا من أن تنمو".
ولادة قلب

وبدأ افتتان تايلور بنمو القلب عام 1998، عندما عملت ضمن فريق في جامعة ديوك حقن خلايا في قلب أرنب توقف عن العمل، ما أدّى إلى تكوين عضلة قلب جديدة. وعندما بدأت التجارب على البشر، كانت نتيجة العملية متأرجحة بين الفشل والنجاح.
وأوضحت تايلور لـCNN: كنا نضع الخلايا في مناطق القلب المتضرّرة أو تلك المشوّهة، على أمل أن نعالج بذلك الضرر الحالي"، قائلة: "بدأت أفكر: ماذا لو تمكنا من التخلص من تلك البيئة السيئة وإعادة بناء المنزل"؟
وحققت تايلور نجاحها الأول عام 2008، عندما قامت مع فريق من جامعة مينيسوتا الأمريكية بغسل الخلايا من قلب فأر، وبدأوا العمل مع الهيكل الشفاف الذي خلّفه ذلك.
وسرعان ما درجت على استخدام قلب الخنازير بسبب تشابهها التشريحي مع قلب البشر.
وأوضحت: "أخذنا قلب خنزير وغسلنا كل الخلايا بشامبو أطفال لطيف"، لافتة إلى أنّ "ما تبقى كان نسيج غشائي خارج الخلية، عبارة عن إطار شفاف أطلقنا عليه اسم القلب الشبح".
وأضافت: "ثم قمنا بضخ خلايا الأوعية الدموية لتنمو على النسيج الغشائي لمدة أسبوعين" لافتة إلى أنّ "ذلك طوّر طريقة لتغذية الخلايا التي سنضيفها لأننا أعدنا تأسيس الأوعية الدموية للقلب".
وكانت الخطوة التالية، البدء بحقن الخلايا الجذعية غير الناضجة في مناطق مختلفة من السقالة، "ثم كان علينا تعليم الخلايا كيف تنمو".
وأوضحت تايلور أنه كان "يتوجب علينا تحفيزها كهربائيًا، إسوة بجهاز تنظيم ضربات القلب، لكن برفق شديد بداية، حتى تصبح أقوى وأقوى. أولاً، سترتعش الخلايا في مكان واحد، ثم ترتعش خلايا أخرى في مكان آخر، لكن كل على حدة". وتابعت أنّه "بمرور الوقت تبدأ الخلايا في المصفوفة بالاتصال مع بعضها، وبحلول شهر تقريبًا، تنبض مع بعضها كقلب. واسمحوا لي أن أخبركم، إنها لحظة رائعة"!
ولكنّ هذه ليست نهاية "الأمومة" التي كان يتعين على تايلور وفريقها القيام بها. إذ يتوجب عليهم الآن رعاية القلب الناشئ عن طريق مدّه بضغط الدم وتعليمه الضخ.
وأوضحت: "نملأ حجرات القلب بالدم الاصطناعي ونترك خلايا القلب تضغط عليها. لكن يجب أن نساعدها بالمضخات الكهربائية، وإلا ستموت".
كما تمّ تغذية الخلايا بالأكسجين من رئتين اصطناعيتين. ولفتت تايلور إلى أنّه في الأيام الأولى كان عليهم مراقبة كل هذه الخطوات وتنسيقها يدويًا على مدار 24 ساعة في اليوم، و7 أيام في الأسبوع.
وشرحت أن "على القلب أن يتغذى يوميًا. وكان على شخص لعب هذا الدور إلى أن نجحنا في بناء القطع التي تخوّلنا مراقبة القلب إلكترونيًا، فلا يهم إن كان عيد الميلاد، أو رأس السنة، أو عيد ميلادك"، مشيرة إلى أنّ الأمر "تطلب العمل مع مجموعات استثنائية على مر السنين لتحقيق ذلك".
لكن ما أن شاهدت تايلور وفريقها نتائج رعايتهم، فإنهم نسوا كل التضحيات، "لأن بعد ذلك شهدنا على الجمال، على السحر".
وروت تايلور أنهم لقحوا "نوع الخلايا ذاتها في كل أنحاء القلب، لذلك بدأت بالعمل جميعها على نحو مماثل". وأردفت: "لكن الآن عندما ننظر إلى البطين الأيسر، نجد خلايا قلب البطين الأيسر. إذا نظرنا إلى الأُذَيْن، تبدو الخلايا مماثلة لتلك التي نقع عليها في القلب الأذيني، وإذا نظرنا إلى البطين الأيمن، نجد خلايا قلب البطين الأيمن".
ولفتت إلى أنه "بمرور الوقت تطورت الخلايا انطلاقًا من المكان الموجودة فيه، وأصبحت تعمل معًا كقلب واحد.. الطبيعة مدهشة، أليس كذلك"؟
مليارات ومليارات من الخلايا الجذعية

ومع الكشف عن منتجها، بدأت تايلور تحلم باليوم الذي يمكن فيه إنتاج قلب نموذجي أولي بكميات كبيرة لآلاف الأشخاص المدرجين ضمن قوائم انتظار الزرع، والذين يتوفى كثر منهم خلال مرحلة الانتظار. لكن كيف يمكنك قياس القلب؟
وشرحت تايلور أنه "مقابل كل غرام من أنسجة القلب التي بنيناها، احتجنا إلى مليار خلية قلب"، مشيرة إلى أنّ "هذا يعني أننا نحتاج إلى نحو 400 مليار خلية فردية لتشكيل قلب بشري بالغ. الآن، تعمل غالبية المختبرات مع مليون خلية أو ما يضاهيها، ولا تنقسم خلايا القلب، الأمر الذي شكل معضلة بالنسبة إلينا: من أين نأتي بهذه الخلايا؟
وحصلنا على الإجابة عندما اكتشف الباحث الياباني في الطب الحيوي الدكتور شينيا ياماناكا أنّ خلايا الجلد البشرية البالغة يمكن إعادة برمجتها لتتصرف مثل الخلايا الجذعية الجَنينيّة أو "متعددة القدرات"، القابلة للتطور إلى أي خلية أخرى في الجسم. وفاز هذا الاكتشاف بجائزة نوبل للعلم عام 2007، وسرعان ما أصبحت "الخلايا الجذعية المحفزة (iPS)" تُعرف باسم "عوامل ياماناكا".
ولفتت تايلور إلى أنه "لأول مرة يمكننا أخذ الدم، أو نقيّ العظام، أو الجلد من شخص ما وزرع خلايا من هذا الشخص يمكن أن تتحول إلى خلايا قلب"، مشيرة إلى أنّ "الحجم المطلوب ما زال هائلاً، لأننا نحتاج إلى عشرات مليارات الخلايا. واستغرق الأمر 10 سنوات أخرى من العمل لتطوير التقنيات للقيام بذلك".
ما الحل؟ كان قرصًا من الألياف مماثل لخلية النحل، يحتوي على آلاف الثقوب المجهرية حيث يمكن للخلايا أن تلتصق وتتغذى.
وشرحت تايلور أنّ " الألياف تمتص العناصر الغذائية تمامًا مثل مرشح القهوة، ويمكن للخلايا الوصول إلى الطعام المحيط بها، الأمر الذي يسمح لها بالتكاثر بأعداد أكبر بكثير. وبالتالي يمكننا الانتقال من حوالي 50 مليون خلية إلى مليار خلية خلال أسبوع".
وأوضحت: "لكننا نحتاج إلى 40 أو 50 أو 100 مليار خلية، لذلك تركّز جزء من عِلمِنا في السنوات القليلة الماضية على زيادة عدد الخلايا التي ثمة إمكانية لدينا لتنميتها".
وواجهت مشكلة أخرى، ومفادها أنّ كل قلب يحتاج إلى بيئة نقية خالية من الملوّثات في كل مرحلة من العملية. وفي كل مرة كان الأمر يستوجب تدخلًا، كانت تعرض القلب لخطر العدوى والموت.
وسألت تايلور جمهور Life Itself: "هل تعرفون كم يستغرق حقن 350 مليار خلية باليد وقتًا"؟ و"ماذا لو لمست شيئًا ما؟ تكون قد لوثت القلب كله".
وفي إحدى المرات تعرّض مختبرها لخلل كهربائي أدى إلى وفاة كل القلوب. لم يكن في الإمكان مواساة تايلور وفريقها حينها.
وبمكن لروبوت BAB، وهو اختصار لـ"BioAssemblyBot"، ومهد "uber-Sterile" الذي أنشأته شركة "Advance Solutions". حمل القلب ونقله من مرحلة إلى أخرى خلال العملية، محافظًا على بيئة خالية من الجراثيم. ولقّنت تايلور BAB العملية المحدّدة لحقن الخلايا التي طورتها، بصعوبة كبيرة، خلال العقد الماضي.
وقال غولواي مبتكر BAB: "عندما حقنت الدكتورة تايلور الخلايا، احتاجت لسنوات لاكتشاف مكان الحقن، ومقدار الضغط الذي يجب وضعه على المحقنة، وأفضل سرعة، لإضافة الخلايا".
وتابع: "يمكن للروبوت أن يفعل ذلك بسرعة وبدقة. كما نعلم أنه لا وجود لقلبين متشابهين، لذلك يمكن لـBAB استخدام الموجات فوق الصوتية لرؤية داخل مسار الأوعية الدموية لهذا القلب المحدّد، وهذا ما تفعله الدكتورة تايلور على نحو أعمى، إذا جاز التعبير".
وتركت تايلور الأوساط الأكاديمية عام 2020، وتعمل حاليًا مع مستثمرين من القطاع الخاص لتقديم ابتكارها إلى الجماهير. وإذا نجحت التجارب السريرية التالية، فيمكن استخدام قلوب تايلور الهجينة المشخصنة لإنقاذ آلاف الأرواح حول العالم.